华大携手复旦中山医院发布最新成果 助力肝内胆管癌精准治疗
发布时间:2022-09-15 16:05:51 | 来源:中国网科学 | 作者: | 责任编辑:科学频道
近日,复旦大学附属中山医院联合深圳华大生命科学研究院(以下简称“华大研究院”)在Cancer Discovery(影响因子:38.272)上发表最新成果,基于来自45例患者的207份肝内胆管癌多区域样本,整合全外显子测序、转录组测序、TCR测序及多色组化等技术,揭示了肿瘤细胞和免疫微环境的互作规律,为肝内胆管癌精准的个体化免疫联合治疗带来了新希望。

Cancer Discovery官网截图
肿瘤其实并不只有肿瘤细胞,它就像一个战场,同时还包含了浸润的免疫细胞、间质细胞和微血管等,我们也称之为肿瘤免疫微环境。
在这个“战场”里,免疫细胞会针对性地识别肿瘤细胞,并将其清除掉。但是,肿瘤细胞也不是这么好欺负的,它会通过各种手段,躲避免疫细胞的“围剿”,最终肆意生长(我们把这个过程叫做免疫逃逸)。不同肿瘤具有不同的免疫微环境特点和免疫逃逸机制,对免疫治疗产生不同潜在效果。
为了阐明免疫微环境是如何影响肝内胆管癌的发展进程,了解肿瘤细胞和免疫细胞“相爱相杀”的过程,促进肝内胆管癌个体化靶向和免疫治疗的研究,研究者对上述45位患者手术切除的肝内胆管癌样本进行了多区域取样(每位患者选取4-6个区域),利用免疫基因组学分析发现,肝内胆管癌不仅在基因组水平表现出极高的肿瘤内异质性,并且在免疫微环境水平也存在巨大差异。
因此,研究者根据患者病灶中的浸润免疫细胞含量,将患者分为了低免疫浸润、高免疫浸润和异质性免疫浸润三种免疫类型,并且根据这三种类型的特点,给出了建议的免疫治疗方式。
另外,综合以上肿瘤的免疫逃逸机制特点,研究者将肝内胆管癌分为了免疫低逃逸和免疫高逃逸两组,肿瘤免疫逃逸能力强(高逃逸)的患者预后更差,这在目前已有数据库CPTAC和TCGA肝内胆管癌队列中均得到验证,为肝内胆管癌的预后分型提供了新的视角,助力患者预后预测。
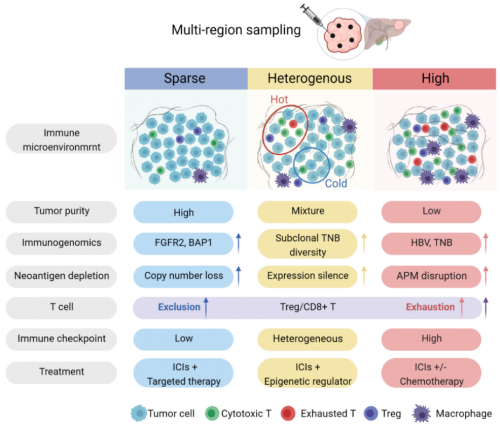
综上,本项研究描绘了肝内胆管癌的肿瘤免疫微环境的相互作用过程,揭示了基因突变对免疫微环境的影响以及免疫微环境中的逃逸机制,为不同类型患者的治疗提供方向,为新型免疫治疗策略的开发提供了新的线索。
据了解,复旦大学附属中山医院高强教授、华大研究院吴逵副研究员和复旦大学附属中山医院樊嘉院士为本文共同通讯作者。复旦中山医院博士生林友培、华大研究院生物信息副研究员彭丽花、复旦中山医院董良庆博士、华大研究院生物信息副研究员刘栋兵为本文共同第一作者。

